Новые шаги генной терапии
У пенсионеров, а также у нездоровых мышечной дистрофией (совместное
заглавие группы болезней) плотно наблюдается убавление
размера и массы мускул. При физических отягощениях в клеточках мускул
непрерывно появляются небольшие повреждения, тот или иной в норме
ликвидируются репаративными налаженностью организма.
Эта способность к возобновленью обеспечивается пребываньем в
клеточке белка дистрофина. При мутациях гена, отвечающего
за синтез этого белка, процессы репарации нарушаются, мышечные
волокна отмирают и заменяются жировой либо фиброзной тканью.
У пенсионеров, а также у нездоровых мышечной дистрофией (совместное
заглавие группы болезней) плотно наблюдается убавленье
размера и массы мускул. При физических отягощениях в клеточках мускул
непрерывно появляются небольшие повреждения, тот или иной в норме
ликвидируются репаративными порядками организма.
Эта способность к возрождению обеспечивается пребываньем в
клеточке белка дистрофина. При мутациях гена, отвечающего
за синтез этого белка, процессы репарации нарушаются, мышечные
волокна отмирают и заменяются жировой либо фиброзной тканью. До
этого времени этот процесс рассчитывался необратимым. И вот ученые
сделали основные шаги для того, чтоб сориентировать людям с ним
биться.
Понятно, что в регуляции мышечного роста участвуют два фактора.
Это инсулиноподобный фактор роста I (IGF-I),
отвечающий за рост мышечных клеток, и белок миостатин,
ингибирующий этот процесс. Ученые Пенсильванского и
Гарвардского институтов решили узнать, нельзя ли
употреблять инсулиноподобный фактор роста для возобновленья
мышечной массы у нездоровых и пенсионеров. Опыты на мышах
изобразили, что ежели нетрудно вводить IGF-I в ткани
скелетных мускул, то он пропадает бесследно сквозь немного
часов, не вызывая никакого эффекта. Ежели же в клеточку вводят
ген, ответственный за синтез IGF-I, то он сохраняется
там долгое период, вызывая рост мышечной ткани, как это
происходит в юном здоровом организме.
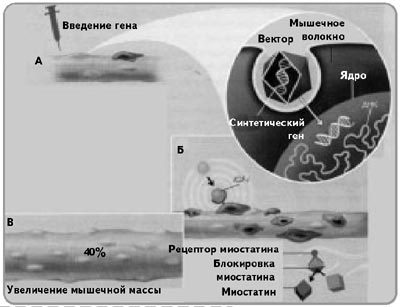
Для адресной доставки гена был применен безобидный
аденоассоциированный вирус, просто проникающий в клеточки
скелетных мускул. В его генный аппарат был встроен ген,
ответственный за синтез фактора IGF-I . Рекомбинантный
вирус был введен юным и взрослым мышам и вызвал приметный
эффект. У юных мышей скорость наращивания мускул и их
суммарная длина возросли на 1530% по сопоставлению с нормой
(при том, что мыши распоряжались неподвижный стиль жизни). В то же
период у взрослых мышей, тот или другой ввели рекомбинантный вирус, с
возрастом не вышло понижения мышечной массы. При всем этом
завышенный ватерпас IGF-I отмечался лишь в мышцах, а в
крови оставался обычным. Это чрезвычайно принципиально, т.к. увеличение
его степени в крови наращивает возможность онкологических
болезней и негативно воздействует на занятию сердца.
Понятно, что мускулы стремительно реагируют на снижение физической
перегрузки, истончаясь и атрофируясь. Введение в клеточки гена
IGF-I и последующее локальное образование в скелетных
мышцах инсулиноподобного фактора роста дозволяет провоцировать
образование мышечной ткани без доп физических
нагрузок. Это раскрывает отличные перспективы в лечении
болезней, связанных с дистрофией мускул. Все-таки пока
проведены едва лишь опыты на мышах. Надлежащий шаг
испытание новейшего способа на собаках. Что дотрагивается жителя нашей планеты, то,
по оценкам исследователей, до внедрения этого способа пройдет
более 10 лет. Пока же планируются тесты на человеке
способов подмены дефектного гена белка дистрофина.
Надобно увидеть, что жаждая в этих исследованиях изготовлены едва лишь
основные шаги, они вызвали суровые волнения в спортивных
кругах. Тяжба в том, что увеличение степени IGF-I
вследствие введения кодирующего его гена наблюдается лишь в
клеточке и никак не находится в крови, потому он приходит
образцовым допингом, тот или иной нереально найти никакими
пробами.
По субстанциям:
Лу Суини. Генный допинг // В мире науки. 10. 2004.
Posted in ЭкоБиология by admin with comments disabled.