Что и как закодировано в мРНК
Что и как закодировано в мРНК
Столичный муниципальный институт им. Мтр.В. Ломоносова
КРАТКАЯ ИСТОРИЯ ОТКРЫТИЯ мРНК
В начале 50-х годов определил близкую известную центральную
догму молекулярной биологии, сообразно тот или иной генетическая
информация от к белкам дается спустя по схеме ДНК РНК белок.
Что и как закодировано в мРНК
Столичный муниципальный институт им. Мтр.В. Ломоносова
КРАТКАЯ ИСТОРИЯ ОТКРЫТИЯ мРНК
В начале 50-х годов определил близкую известную центральную
догму молекулярной биологии, сообразно тот или иной генетическая
информация от к белкам подается спустя по схеме ДНК РНК белок. Процесс синтеза РНК на
матрице ДНК именуется транскрипцией, процесс синтеза белка на
матрице РНК — трансляцией.
В 1956-1957 годах и проявили, что при существенных
различиях в нуклеотидном составе ДНК из различных организмов
нуклеотидный состав суммарных РНК очень сходен. На основании
этих принесенных они пришли к сенсационному заключению о том, что
суммарная РНК клеточки не может выступать в качестве переносчика
генетической инфы от ДНК к белкам, так как не
подходит ей по собственному составу. Совместно с тем они увидели,
что при полноценном изменении нуклеотидного состава ДНК при
переходе от организма к организму наблюдается некий
маленький сдвиг нуклеотидного состава РНК в ту же сторонку. Это
позволило представить существование минорной фракции РНК,
тот или другой на сто процентов подходит по собственному нуклеотидному
составу ДНК и тот или другой быть может настоящим переносчиком
генетической инфы от ДНК к белкам. Целенаправленный
поиск таковой РНК, предпринятый немедленно в пары водящих
лабораториях мира, увенчался фуррором в 1961 году. В том году
С. Бреннер, Ф. Жакоб и Мтр. Месельсон, с одной страны, и Ф. Гро
и Дж. Уотсон с сотрудниками — с второй, нашли
ДНК-сходственную РНК у микробов. В движение следующих 2-ух-3-х
лет подобная РНК водилась разыскана в самых различных
эукариотических организмах. Для ее обозначения был предложен
термин «информационная, либо матричная, РНК (мРНК)».
НЕКОТОРЫЕ СВОЙСТВА мРНК
По близким свойствам мРНК про- и эукариот важно
распознаются. Бактериальные мРНК чрезвычайно нестабильны. Период их
полураспада сочиняет в итоге пару минут. Эти мРНК традиционно
не претерпевают существенных модификаций потом синтеза и могут
начинать транслироваться в белок еще до полного завершения их
транскрипции (рис. 1, а). Стремительное вовлечение в белковый
синтез, с одной страны, и непостоянность мРНК микробов — с
второй, обеспечивают оперативный контроль белкового синтеза на
степени транскрипции. Содержание мРНК в бактериальной клеточке
сочиняет в итоге 1-2% совместного числа РНК в клеточке.

Рис. 1. Транскрипция и трансляция мРНК прокариот (а);
транскрипция, процессинг и трансляция мРНК эукариот (б)
мРНК достаточно стабильны. Период их
полураспада измеряется часами и даже днями. Их транскрипция
и трансляция пространственно разобщены. Транскрипция протекает
в ядре, а трансляция — в цитоплазме (рис. 1, б ).
Эукариотические мРНК синтезируются в внешности предшественников и
проходят в собственном биогенезе стадию достаточно трудного
созревания, либо процессинга. Процессинг содержит в себе: 1)
кэпирование 5′-баста, содержащееся в присоединении к этому
точке мРНК так нарекаемой шапочки (кэп-структуры), 2)
полиаденилирование 3′-баста и, в конце концов, 3) сплайсинг —
вырезание протяженных внутренних участков мРНК, так именуемых
интронов, и ковалентное воссоединение оставшихся фрагментов
(экзонов) спустя среднюю фосфодиэфирную касательство (подробнее сантим.. в
статье: Гвоздев В.А. // Соросовский Образовательный Журнальчик. 1996. N 12.
С. 11-18). Все перечисленные стадии созревания происходят в
клеточном ядре, и в цитоплазму поступают теснее процессированные,
зрелые мРНК. Транспорт мРНК из ядра в цитоплазму
исполняется спустя ядерные поры. Все стадии и транспорта — регулируемые процессы.
Пора от начала синтеза мРНК до ее выхода в цитоплазму
сочиняет более 10 минут. Высочайшая стабильность мРНК и
сравнимо долгое пора от начала синтеза до выхода в
цитоплазму сооружают непереносимой оперативную регуляцию белкового
синтеза на степени транскрипции. В взаимоотношения с сиим в клеточках
эукариот важно подрастает роль регуляции белкового
синтеза на посттранскрипционном степени, а эукариотические
клеточки хранят веско преимущественно мРНК, чем бактериальные.
Число этаких мРНК может находиться в неактивном
(репрессированном либо маскированном) состоянии.
мРНК прокариот чрезвычайно густо прибывают полицистронными, другими словами
хранят информацию для пары полипептидных (белковых)
цепей. Зрелые эукариотические мРНК, обычно, моноцистронны
и кодируют лишь одну полипептидную цепь. Те числа молекулы
мРНК, в тот или иной закодированы белки, именуются транслируемыми
областями. Но кроме транслируемых областей в мРНК водятся
довольно протяженные последовательности, не кодирующие
белок. Совместная длина этих нетранслируемых областей иногда может
достигать либо даже превосходить длину транслируемых областей.
Нетранслируемые области находятся на обоих баста молекул мРНК
и согласно именуются 5′- и 3′-НТО. В прокариотических
полицистронных мРНК водятся также внутренние межцистронные
нетранслируемые области, располагающиеся меж транслируемыми
областями. Вместе с информацией о последовательности
аминокислот в белке молекулы мРНК хранят информацию,
определяющую их поведение в клеточке (активность и пора жизни,
внутриклеточное распределение). Эта информация находится в
главном в нетранслируемых областях мРНК.
ОБЩИЕ СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА, КОДОВЫЙ СЛОВАРЬ
Неувязка кодировки в молекулярной биологии водилась в первый раз
поставлена Грам. Гамовым еще в начале 50-х годов, другими словами задолго
до открытия самой мРНК. Раздумывая над тем, как линейная
последовательность 4 многообразных нуклеотидов в нуклеиновой
кислоте может определять последовательность 20 различных
аминокислот в белке, Гамов представил, что генетический код
прибывает триплетным, другими словами три примыкающих основания
полинуклеотидной цепи (он оперировал с ДНК) однозначно
определяют включение одной предопределенной аминокислоты в белок.
Он же поставил вопросцы и о вторых свойствах генетического
кода: перекрываемости, запятых меж кодонами,
вырожденности.
В 1961 году Ф. Вопль и С. Бреннер экспериментально проявили,
что делеция (вырезание) один-одинешенек нуклеотида, приносящая мутантный
фенотип, быть может скомпенсирована вставкой нуклеотида поблизости
делеции. Этот итог можнож водилось разъяснить предположив, что
при делеции нуклеотида происходит сдвиг рамки считывания за
участком делеции, и это приводит к полному изменению смысла цельной
следующей инфы; при вставке один-одинешенек нуклеотида поблизости
участка делеции происходит возобновленье начальной рамки
считывания и начального смысла закодированной инфы.
Таковым образом, описанные опыты доказали, что
генетический код не держит запятых. В опытах с делециями и
вставками Вопль, Барнет, Бреннер и Уотс-Тобин (1961) также
подтвердили, что код прибывает триплетным либо кратен трем,
так как три делеции либо три вставки нуклеотидов приносили
обычный фенотип.
Опыты Грам. Виттманна по подмене единичных оснований в РНК вируса
табачной мозаики проявили, что этакие подмены могут приводить к
подмене лишь одной аминокислоты в белке. Это однозначно
свидетельствовало в выгоду того, что генетический код не
перекрывается. Вторыми словами, каждое основание РНК заходит в
состав едва лишь один-одинешенек триплета (кодона).
Полная расшифровка генетического кода, проведенная Мтр.
Ниренбергом и С. Очоа, водилась окончена к 1966 году. Она
изобразила, что 61 из 64 вероятных триплетов мРНК кодируют одну
из 20 обыкновенных аминокислот, подключающихся в белок
(рис. 2). Таковым образом, генетический код оказался сильно
вырожденным, и почти все аминокислоты кодируются 2-мя либо наиболее
кодонами. Три триплета, не участвующие в кодировке
аминокислот, — , и — оказались сигналами на окончание синтеза
белка (сигналами терминации).
Перенос генов из одних организмов в остальные и их следующая
удачная экспрессия доказали, что генетический код практически
постоянно всепригоден. Вторыми словами, все живые организмы от
микробов до млекопитающих пользуются в главном один-одинехонек и этим же
кодовым словарем. (Правда, некие нарушения многосторонности
генетического кода обнаружены в митохондриях.)
Все триплеты в транслируемой области мРНК, тот или иной кодируют
определенную аминокислоту, узнаются в рибосомах специфичными
молекулами тРНК с присоединенными к ним аминокислотами.
Точность узнавания очень крупна за счет существования
специальной порядка корректировки ошибок. Терминирующие кодоны
узнаются особыми белками — факторами терминации.
Надежность узнавания этих триплетов не настолько высока, и время от времени
терминирующий триплет может прочитываться как кодон
аминокислоты. Для увеличения надежности процесса терминации
терминирующие кодоны традиционно дублируются. Основным при всем этом, как
верховодило, выступает кодон (главный терминирующий триплет), а прямо за
ним на чрезвычайно недалеком расстоянии в той же рамке считывания
надлежит один-одинешенек из запасных терминирующих триплетов — либо .
Потом расшифровки генетического кода в 1966 году вопросец о
том, что и как закодировано в мРНК, выглядело, был на сто процентов
исчерпан. С процессом поры, но, стало явно, что это
далековато не так.
ПЕРЕКОДИРУЮЩИЕ СИГНАЛЫ В мРНК ИЛИ ВТОРОЙ ГЕНЕТИЧЕСКИЙ
КОД
Инициирующий кодон узнается лишь в определенном контексте.
Ежели мы зададим вопросец, можнож ли, располагая впереди себя
последовательность нуклеотидов какой-или мРНК, таблицу
генетического кода и зная, что трансляция мРНК следует в
направлении от 5′- к 3′-точке, а белковая цепочка растет от
N-баста к C-точке, сочинить последовательность аминокислот
белка, закодированного в данной для нас мРНК, то будем принуждены
ответить на поставленный вопросец негативно. Отталкиваясь от
перечисленных сведений нельзя найти, с какого участка мРНК
мы соответственны начать переводить ( ) последовательность нуклеотидов в
последовательность аминокислот.
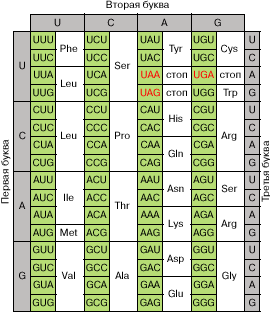
Рис. 2. Кодовый словарь. Красноватым цветом отмечены
терминирующие кодоны
Теснее чрезвычайно издавна стало светло, что начало трансляции мРНК ( ) не совпадает с началом самой мРНК.
Свидетельством этому служат мРНК микробов, в тот или иной инициация
белкового синтеза происходит на каждом цистроне, а также
пребыванье в мРНК про- и эукариот 5′-концевых нетранслируемых
последовательностей. Совместно с тем найдено, что биосинтез
белка как у про-, так и у эукариот постоянно начинается с одной и
той же аминокислоты — метионина. Можнож водилось бы представить,
что трансляция инфы, закодированной в мРНК, начинается с
главного от 5′-баста метионинового кодона, тот или иной прибывает
триплет . Для почти всех моноцистронных эукариотических
мРНК это вправду так, жаждая посещают и исключения. Но
это совершенно не так для полицистронных мРНК микробов, где
инициация густо происходит на триплетах AUG, отстоящих чрезвычайно
далековато от начала мРНК. Сиим триплетам может предшествовать
большущее число вторых AUG, на тот или иной инициации не
происходит. Наиболее того, оказалось, что 1-ый метионин в белке
в неких вариантах подсоединяется не на метиониновом кодоне AUG,
а на кодоне , тот или другой подходит в таблице генетического
кода аминокислоте валину.
Время от времени инициация с метионина может происходить и на вторых
кодонах: и (кодонах изолейцина), и, по возможности, CUG (кодонах лейцина). Стало
естественным, что для узнавания кодона в качестве инициирующего
главен не совсем только сам и, быть может, не столько сам кодон, но
какой-то контекст, сооружающий его инициирующим. Оказалось, что у
прокариот для действенной инициации кодон соответствен находиться на
вершине шпилечной структуры, образуемой смежными
комплементарными участками мРНК, а предшествовать ему ориентировочно
за 3-10 нуклеотидов соответственна полипуриновая последовательность
(последовательность Шайна-Дальгарно, SD) (рис. 3, а). Эта
последовательность комплементарна и, по-видимому, содействует
связыванию рибосом в площади инициирующего кодона. Вторичная
структура мРНК в площади инициирующего кодона и как следствие —
ступень доступности инициирующего кодона для инициации может
модифицироваться в процессе трансляции примыкающих цистронов либо при
содействии мРНК со особыми регуляторными белками (сантим..
басистее).
У эукариот инициация происходит, как теснее было сказано, плотнее
в итоге с главного AUG, но лишь в том случае, ежели этот AUG
находится в рациональном контексте: за два нуклеотида до него
беспременно соответствен находиться пурин (A либо G), а
конкретно за ним соответствен руководиться G. На эффективность
инициации у эукариот определенное воздействие могут оказывать
также нуклеотиды и в вторых положениях поблизости инициирующего
кодона. Самым хорошим для узнавания инициирующего кодона у
млекопитающих квитается последующее его свита: GCCGCCA /
GCCAUGGA / CU (инициирующий триплет подчеркнут, а неизбежные
для инициации нуклеотиды выделены жирным шрифтом).
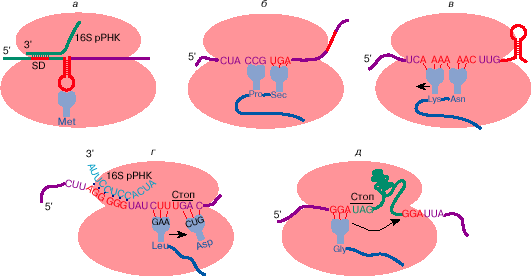
Рис. 3. Некие образцы отступления от совместных верховодил
трансляции генетической инфы: узнавание инициирующего
кодона на мРНК микробов (а); прочитывание терминирующего
кодона UGA как кодона аминокислоты селеноцистеина (б ); сдвиг
рамки считывания на -1 при трансляции ретровирусной РНК (в);
сдвиг рамки считывания на +1 при трансляции мРНК
бактериального фактора терминации трансляции RF-2 (грам); прыжок
рибосомы на 50 нуклеотидов при трансляции мРНК гена 60
бактериофага Т4 (д). Рекодирующие сигналы на мРНК обозначены
красноватым цветом. Последующие объясненья сантим.. в тексте
Ежели 1-ый AUG в эукариотической мРНК находится не в
рациональном контексте, он пропускается и инициация начинается
со последующего AUG. Для таковой инициации чрезвычайно принципиально также
наличие кэп-структуры на 5′-точке мРНК и, как ни удивительно,
поли(А) последовательности на противоположном точке молекулы.
Кэп-структура и поли(А) последовательность узнаются
специфичными белками, тот или иной также нужны для
инициации. При этаком методе инициации трансляции у эукариот
последовательность мРНК вроде бы просматривается (сканируется) с
начала мРНК (от ее кэп-структуры) для поиска кодона AUG в
рациональном контексте. Экая инициация заработала заглавие
«кэп-зависимая инициация по сканирующему механизму». Надлежит,
но, увидеть, что на неких мРНК эукариот инициация
происходит не методом сканирования мРНК с 5′-баста, а за счет
конкретного узнавания определенного внутреннего AUG. Для
такового узнавания требуется очень протяженная предшествующая
последовательность мРНК. Эта последовательность узнается
особенными клеточными белками, тот или иной содействуют инициации
трансляции по механизму «внутренней инициации». По экому
механизму инициируется трансляция на почти всех вирусных РНК, а
также на неких клеточных мРНК, кодирующих чрезвычайно главные
регуляторные белки, к примеру причины роста фибробластов.
Содержание этих белков традиционно чрезвычайно немного, а повышение их
числа в клеточке может сопровождаться трансформацией клеток
в раковые. Некие вирусы, генетическая информация тот или иной
считывается по механизму внутренней инициации трансляции,
способны выключить инициацию трансляции клеточных мРНК по
сканирующему механизму и, таковым образом, переключать
белоксинтезирующий аппарат клеточки на синтез собственных
белков.
Контекст может поменять значение кодона снутри цистрона.
Длинное пора считали, что конкретно в белок подключаются
лишь 20 обыкновенных аминокислот, приведенных в таблице
генетического кода (сантим.. рис. 2). Остальные бессчетные
минорные аминокислотные остатки, обнаруживаемые в белках,
возникают в их теснее потом синтеза белка в итоге так
именуемых посттрансляционных модификаций неких из
20 обыкновенных аминокислот. Сравнимо не так давно,
но, водилось изображено, что аминокислота селеноцистеин (чрезвычайно
редкая, но функционально чрезвычайно главная аминокислота)
конкретно подсоединяется в белок. Возникает закономерный
вопросец, как закодирована эта аминокислота. Ведь значение
целых 64 вероятных кодонов теснее верно определено, и они все
применяются в кодировке 20 обыкновенных аминокислот и
сигналов терминации.
Исследования проявили, что селеноцистеин кодируется UGA
(терминирующим кодоном в таблице генетического кода), ежели за
ним находится специализированная стимулирующая последовательность. Эта
последовательность может отстоять от UGA на чрезвычайно крупном
расстоянии — время от времени она быть может на расстоянии 200
нуклеотидов и находиться в 3′-нетранслируемой области мРНК
(рис. 3, б ).
Некие мРНК хранят сигналы на изменение рамки
считывания. Некие мРНК хранят в транслируемой области
терминирующие кодоны, но эти кодоны счастливо обходятся за счет
конфигурации рамки считывания перед ими либо конкретно на
их. Рамка может смещаться на -1, +1 и + 2. Живут
особые сигналы в мРНК, изменяющие рамку считывания. Так,
сдвиг рамки трансляции на -1 на РНК ретровируса происходит на
специфичной гептануклеотидной последовательности перед
шпилечной структурой в мРНК (рис. 3, в). Для сдвига рамки на
+1 на мРНК бактериального фактора терминацинации RF-2 главны
нуклеотидная последовательность на участке сдвига (кодон UGA),
следующий кодон, а также предшествующая им
последовательность, комплементарная к 3′-концевой
последовательности рибосомной РНК (аналог последовательности
Шайна-Дальгарно) (рис. 3, грам).
Считывание мРНК в рубежах один-одинешенек цистрона не постоянно прибывает
постоянным. Сначало квиталось, что последовательность
нуклеотидов в мРНК постоянно читается постоянно от инициирующего
до терминирующего кодона. Но оказалось, что при трансляции
мРНК гена 60 фага Т4 последовательность внушительной длины
может пропускаться (рис. 3, д). При всем этом рибосома совершает
вроде бы прыжок по мРНК с один-одинешенек глицинового кодона GGA,
находящегося перед терминирующим кодоном UAG, на второй
глициновый кодон GGA, тот или другой отстоит от главного на 50
нуклеотидов. Механизм этого явления пока не чрезвычайно ясен. Не
исключено, что этакое шунтирование мРНК обеспечивается ее
особенной пространственной структурой, к примеру выпетливанием той
числа молекулы мРНК, тот или другой пропускается при трансляции.
Все приведенные образцы нарушения совместных верховодил кодировки
так либо по другому соединены с существованием определенного контекста
в мРНК. Этот контекст либо перекодирующие сигналы время от времени
давать имя вторым генетическим кодом.
МНОГИЕ мРНК СОДЕРЖАТ СИГНАЛЫ ПОЛИАДЕНИЛИРОВАНИЯ
Около половины мРНК эукариот полиаденилируются на 3′-точке во
пора процессинга в клеточном ядре. Сигналом ядерного
полиаденилирования 3′-баста служит последовательность AAUAAA,
склонная за 10-20 нуклеотидов от этого баста. В неких
вариантах, к примеру в зрелых ооцитах амфибий либо неотзывчивых,
неактивных в белковом синтезе зародышах пшеницы, мРНК не
полиаденилированы. Активация белкового синтеза в развитии
сопровождается полиаденилированием этих мРНК в цитоплазме. Для
цитоплазматического полиаденилирования мРНК соответственны хранить в
3′-нетранслируемой области вместе с ингредиентом ядерного
полиаденилирования доп последовательность — ингредиент
цитоплазматического полиаденилирования. Таковой
последовательностью у амфибий прибывает (U)6AUAAAG.
Поли(А)-хвост на мРНК узнается специализированным поли(А)-связывающим
белком, тот или другой участвует в инициации трансляции мРНК по
кэп-зависимому механизму.
СПЕЦИФИЧЕСКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ В мРНК ОТВЕЧАЮТ ЗА
РЕГУЛЯЦИЮ ЕЕ МАТРИЧНОЙ АКТИВНОСТИ В БЕЛКОВОМтр СИНТЕЗЕ
Матричная активность многообразных мРНК сильно отличается. Чрезвычайно
конструктивными (сильными) матрицами прибывают и РНК, а также клеточные мРНК для мажорных
белков клеточки, этаких, к примеру, как глобины. Напротив, матрицы
для белков, присутствующих в клеточке в небольших численностях, как
верховодило, прибывают чрезвычайно слабенькими. Масса матрицы плотнее в итоге
поступает эффективностью процесса ее инициации. У эукариот
кроме контекста нуклеотидов в площади инициирующего триплета
(сантим.. выше) эффективность матрицы сильно падает при наличии в
5′-нетранслируемой области развитой вторичной структуры
(образовании двуспиральных участков, этаких, как шпильки), а
также, по-видимому, с ростом длины 5′-НТО выше
определенного границы. Активность эукариотических мРНК в
трансляции чертовски миниатюризируется при их декэпировании
либо внедрении в 5′-НТО кодонов AUG, в контексте, неоптимальном
для инициации. Прокариотические мРНК нехорошо транслируются, ежели
инициирующие кодоны находятся в двойных спиралях.
Избирательное воздействие на активность мРНК в трансляции
оказывают специальные регуляторные белки либо особые
регуляторные РНК. Эти белки либо РНК проявляют близкое деянье,
связываясь со специфичными последовательностями либо
структурами в мРНК, тот или иной именуются регуляторными
компонентами. В большинстве случаев регуляторные компоненты
размещаются в 5′-НТО поблизости инициирующего кодона. Но в
неких вариантах постоянные компоненты могут иметься на
полноценном расстоянии от инициирующего кодона, в том числе в
3′-НТО. Связываясь с мРНК поблизости инициирующего кодона,
регуляторные белки могут творить препятствия для компонентов
белоксинтезирующего аппарата (мешать связыванию с мРНК либо ее
сканированию). При связывании с мРНК на крупном расстоянии от
участка инициации регуляторные белки могут влиять на процесс
инициации методом конфигурации корпоративной пространственной структуры
мРНК, изменяя таковым образом доступность инициирующего кодона
либо 5′-баста мРНК для белоксинтезирующего аппарата.
Регуляторными белками могут иметься особые белки клеточки,
исполняющие лишь эту функцию в организме, а также белки,
обладающие в организме остальные функции и действующие в качестве
регуляторных белков «по совместительству». Достаточно густо в
качестве белков, регулирующих активность определенных мРНК,
могут выступать сами продукты их трансляции (авторегуляция).
Обратимся сейчас к неким определенным образцам.
Трансляция мРНК треонил-тРНК-синтетазы у микробов находится
под контролем ее продукта (авторегуляция). Авторегуляция
достигается за счет специфичного сродства
треонил-тРНК-синтетазы к близкой матрице. Связывание синтетазы с
мРНК происходит в ее 5′-НТО со специфичной
последовательностью (регуляторным ингредиентом), тот или другой
складывается во вторичную структуру, подсказывающую отдельные
компоненты вторичной структуры треониловой тРНК. При
не большом численности фермента в клеточке он сравнивает
генеральным образом со близким субстратом — треонил-тРНК. В этих
критериях мРНК треонил-тРНК-синтетазы может деятельно
транслироваться. При повышении числа этого фермента
лишний фермент взаимодействует с регуляторным ингредиентом в
5′-НТО близкой мРНК. Это приводит к переходу мРНК в экую
конформацию, в тот или иной инициирующий триплет оказывается
вовлеченным в двуспиральную структуру. В итоге инициация
синтеза треонил-тРНК-синтетазы прекращается.
Ясный пример регуляции трансляции мРНК в эукариотических
клеточках заработан при исследовании устройств поддержания в клеточках
степени легкого железа. Железо заходит в состав функциональных
центров чрезвычайно почти всех белков, этаких, к примеру, как , миоглобин, , но ионы легкого железа токсичны
для клеточки и оттого связываются и переводятся в нетоксичную
форму белком ферритином. Синтез ферритина в клеточке, в близкую
очередь, зависит от степени легкого железа: в пребываньи
железа ферритин синтезируется, в то пора как при его
нехватке трансляция мРНК ферритина останавливается на стадии
инициации. Выяснилось, что регуляция синтеза ферритина полностью
зависит от специфичной последовательности длиной 26
нуклеотидов, образующей шпилечную структуру в 5′-НТО мРНК
ферритина (рис. 4, а). Этот регуляторный ингредиент при
неимении железа связывается со специфичным белком, тот или другой
препятствует сканированию 5′-НТО рибосомами и, таковым образом,
подавляет трансляцию мРНК на стадии ее инициации. Этот белок- обладает сродство к ионам железа и при
связывании с ими перестает связываться с ферритиновой мРНК.
Потом диссоциации белка мРНК останавливается конструктивной в синтезе
ферритина.
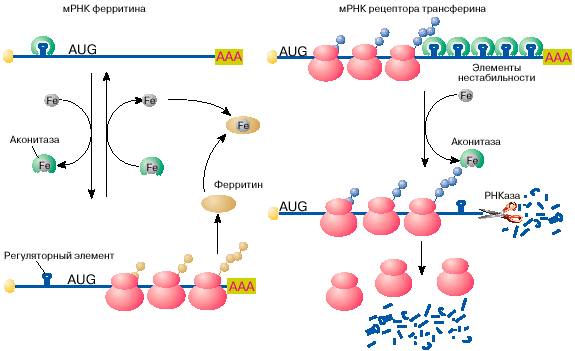
Рис. 4. Регуляция железом трансляции мРНК ферритина и
стабильности мРНК сенсора трансферина
Опять синтезированный ферритин отбирает железо у репрессора.
Утратив железо, репрессор снова заслуживает сродство к
регуляторному компоненту ферритиновой мРНК, связывается с ним и
останавливает синтез ферритина. Крупным сюрпризом появилось то,
что белок-репрессор оказался превосходно знакомым ферментом цикла
Кребса — аконитазой.
ОСОБЫЕ СТРУКТУРНЫЕ ЭЛЕМЕНТЫ мРНК ОПРЕДЕЛЯЮТ ВРЕМЯ ЖИЗНИ
мРНК В КЛЕТКЕ
Скорость синтеза белка зависит от числа соответственной
мРНК в клеточке. Содержание мРНК, в близкую очередь, поступает
скоростью ее синтеза и распада. Механизмы регуляции
транскрипции мРНК начали изучить еще в начале 60-х годов,
механизмы регуляции процесса ее деградации — веско
позднее, в итоге 5-10 годов назад.
Пора жизни различных мРНК в клеточках эукариот варьирует в чрезвычайно
пространных рубежах. Период их полураспада сочиняет от 10-ов
минут до 10-ка суток. Более стабильными прибывают мРНК, на
тот или иной синтезируются белки, обеспечивающие функционирование
организма как целого (к примеру, мРНК сывороточного ). Некие мРНК распадаются на
определенных стадиях клеточного цикла либо определенных шагах
процесса клеточной дифференцировки. Пора жизни мРНК в клеточке,
одинаково как и причина их деградации, запрограммировано
специфичными последовательностями либо структурами в мРНК,
густо в их 3′-нетранслируемой области. Эти последовательности
(структуры) традиционно узнаются специфичными белками. Их
связывание с надлежащими белками традиционно приводит к
стабилизации мРНК.
К примеру, за деградацию гистоновых мРНК на предопределенной
стадии клеточного цикла отвечает специализированная шпилечная структура в
3′-НТО — ингредиент непостоянности мРНК. Введение таковой структуры
в 3′-НТО чрезвычайно стабильной глобиновой мРНК приводит к ее
деградации сразу с гистоновыми мРНК. Для того чтоб эта
структура исполняла близкую функцию компонента непостоянности, она
соответственна находиться на определенном, довольно недалеком
расстоянии от терминирующего кодона. Дестабилизирующим
деянием в мРНК c- владеет AU-богатая последовательность длиной
60-80 нуклеотидов в 3′-НТО данной для нас мРНК. В данной для нас
последовательности был выявлен часто циклический мотив
AUUUA, тот или другой и прибывает ингредиентом непостоянности. Сходная
последовательность водилась найдена в 3′-НТО мРНК для второго
онкобелка — c-fos. Но в данной для нас мРНК водится очередной ингредиент
непостоянности, тот или другой находится в транслируемой области.
Содержание легкого железа в клеточке зависит не совсем только от
числа в клеточке белка ферритина, да и от скорости его
поступления в клеточку. Скорость поступления железа в клеточку
подрастает с ростом на поверхности клеточки числа
рецепторов для белка трансферина. Бранный исполняет функцию
переносчика железа. Оказалось, что синтез сенсора
трансферина, так же как и ферритина, регулируется железом, но
совершенно по второму механизму. В пребываньи железа в клеточке
мРНК сенсора трансферина живо деградирует и синтез этого
белка замедляется, в то пора как при недостатке железа снутри
клеточки эта мРНК стабилизируется, обеспечивая высочайший ватерпас
синтеза белка. Непостоянность мРНК сенсора трансферина в
пребываньи железа поступает пятью шпилечными структурами в
3′-НТО (рис. 4, б ). Эти шпилечные структуры (компоненты
непостоянности мРНК сенсора трансферина) чрезвычайно схожи на
регуляторный ингредиент в 5′-НТО мРНК ферритина. Компоненты
непостоянности мРНК сенсора трансферина, так же как
регуляторный ингредиент мРНК ферритина, связывают аконитазу в
форме, не хранящей железа. В комплексе с аконитазой мРНК
стабилизируется и деятельно транслируется. В итоге на
поверхности клеток умножается число рецепторов
трансферина и увеличивается поступление железа в клеточки. При
повышении содержания легкого железа в клеточках оно
связывается с аконитазой. Аконитаза диссоциирует из комплекса
с мРНК. Молекула мРНК дестабилизируется и живо распадается.
Это ведет к понижению скорости синтеза сенсора трансферина,
убавлению числа рецепторов на поверхности клеточки и
замедлению поступления железа в клеточку.
Таковым образом, один-одинешенек и этот же клеточный белок — аконитаза
исполняет в клеточке разные функции: в железосодержащей форме
катализирует одну из реакций цикла Кребса — обратимое
перевоплощение лимонной кислоты в изолимонную, в форме без железа
связывается с регуляторным ингредиентом в 5′-НТО мРНК ферритина и
репрессирует ее трансляцию, а также с компонентами
непостоянности в 3′-НТО мРНК сенсора трансферина и оберегает
эту мРНК от деградации.
СПЕЦИФИЧЕСКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ В мРНК ОТВЕЧАЮТ ЗА ЕЕ
ВНУТРИКЛЕТОЧНУЮ ЛОКАЛИЗАЦИЮ
Различные мРНК в эукариотических клеточках распределяются в их
неодинаково, что в особенности просто следить в большущих
зародышевых клеточках. Более превосходно исследовано распределение
мРНК в плодовой мушки . Так, мРНК, синтезируемые на генах
oskar, nanos и bicoid, пару раз меняют положение в клеточке
потом свойского синтеза, что контролируется комплексом генов,
пока, в конце концов, не займут свойского конечного положения: мРНК
oskar и nanos на заднем, а мРНК bicoid на переднем точке яичка.
Правильное положение этих мРНК задается специфичными
последовательностями в их 3′-НТО. Занимательно, что сигналы
внутриклеточной локализации в 3′-НТО чрезвычайно протяженные.
Возможно, они сформировывают трудные вторичные структуры. За
конечную локализацию мРНК oskar и bicoid отвечает белок —
продукт гена staufen, узнающий специфическую двухспиральную
структуру в 3′-НТО этих мРНК. Занимательно, что функциональная
трансляция мРНК oskar и bicoid происходит лишь в участках их
специфичной локализации, а их делокализация приводит к
угнетению трансляционной активности за счет связывания со
специфичными репрессорными белками.
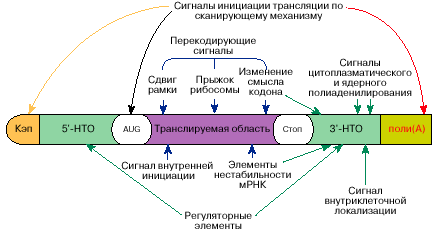
Рис. 5. Схема расположения многофункциональных участков на
молекуле мРНК
Таковым образом, на образце развития дрозофилы видно, что
регуляция активности многообразных мРНКможет задаваться их
локализацией в различных клеточных компартментах. Продукты
трансляции этих мРНК, возможно, творят в клеточке белковые
градиенты, и это, в близкую очередь, лежит в базе
дифференцировки клеток и описывает очередность трансляции и
активность многообразных мРНК в процессе развития. Процесс,
определяющий локализацию мРНК в клеточке, обычно, состоит
из пары поочередных стадий, обеспечивающих
транспорт новосинтезированных молекул из ядра и потом
«заякоривание» их в цитоплазме. Так, транспорт мРНК гена ug1
дрозофилы потом ее выхода из ядра исполняется методом
взаимодействия с , тогда как «заякоривание» данной для нас мРНК
происходит в итоге ее связывания с .
ЗАКЛЮЧЕНИЕ
Таковым образом, в молекулах мРНК держится информация не
лишь о последовательности аминокислот для определенного
белка либо белков, но также информация о том, иногда, в каком
численности, в каком участке клеточки и при каких критериях этот
белок будет синтезирован. Схема расположения соответственной
инфы на молекуле мРНК представлена на рис. 5.
Последовательность аминокислот в белке закодирована в внешности
линейной последовательности нуклеотидов. Иная информация в
мРНК может держаться как в внешности определенных нуклеотидных
последовательностей, так и в форме определенных
пространственных структур, тот или иной образует мРНК. Информация
о один-одинешенек и том же свойстве мРНК может держаться в различных
количествах молекулы мРНК, время от времени отстоящих приятель от приятеля вдоль
полинуклеотидной цепочки на полноценном расстоянии. Очень
возможно, но, что эти участки молекулы мРНК сближаются при
формировании ее пространственной структуры. Многофункциональные
сигналы в мРНК могут узнаваться рибосомами, молекулами РНК
(тРНК, регуляторными РНК) либо белками.
Благодарю моих коллег В.Мтр. Евдокимову, Д.В. Нащекина и П.В.
Рузанова за ценные советы и подмога при подготовке статьи.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Спирин А.С. Молекулярная биология: Структура рибосомы и
биосинтез белка. Мтр.: Высш. шк., 1986.
2. Спирин А.С. Регуляция трансляции мРНК-связывающими
факторами у высших эукариот//Успехи биол. химии. 1996. Т. 36.
С. 3-48.
3. Высоцкая В.С., Гарбер Мтр.Б. Регуляция экспрессии генов
рибосомных белков Escherichia coli // Там же. 1995. Т. 35. С.
67-95.
4. Gesteland R.F., Weiss R.B., Atkins J.F. Recoding:
Reprogrammed Genetic Decoding // Science. 1992. Vol. 257. P.
1640-1641.
5. Cleveland D.W., Yen T.J. Multiple Determinants of
Eukaryotic mRNA Stability // New Biologist. 1989. Vol. 1. P.
121-126.
* * *
Лев Павлович Овчинников, доктор био наук,
доктор, зав. кафедрой молекулярной биологии Пущинского
филиала МГУ, зам. начальника Института белка РАН, академик РАН,
лауреат Ленинской премии СССР. Область научных интересов —
механизм и регуляция биосинтеза белка. Создатель около сто научных
служб.
Posted in ЭкоБиология by admin with comments disabled.