Белки
Белки
Аминокислоты структурные составляющие белков.Белки, либо
протеины (греч. protos главный), это
био гетерополимеры, мономерами тот или иной прибывают
аминокислоты.
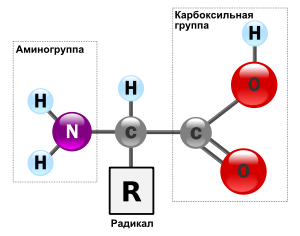
Аминокислоты препровождают собой низкомолекулярные органические
соединения, хранящие карбоксильную (-СООН) и аминную
(-NH2) группы, тот или иной соединены с один-одинехонек и этим же
атомом углерода. К атому углерода приобщается боковая цепь
какой-или радикал, придающий каждой аминокислоте
определенные характеристики.
Белки
Аминокислоты структурные составляющие белков.Белки, либо
протеины (греч. protos главный), это
био гетерополимеры, мономерами тот или другой прибывают
аминокислоты.
Аминокислоты доставляют собой низкомолекулярные органические
соединения, хранящие карбоксильную (-СООН) и аминную
(-NH2) группы, тот или иной соединены с один-одинешенек и этим же
атомом углерода. К атому углерода приобщается боковая цепь
какой-или радикал, придающий каждой аминокислоте
определенные характеристики. Общественная формула аминокислот располагает вид:
У большей числа аминокислот имется одна карбоксильная группа
и одна аминогруппа; эти аминокислоты именуются
нейтральными. Живут, все-таки, и главные
аминокислоты с наиболее чем одной аминогруппой, а также
кислые аминокислоты с наиболее чем одной карбоксильной
группой.
Не тайна около 200 аминокислот, встречающихся в живых
организмах, все-таки только лишь 20 из их входят в состав белков.
Это так-называемые главные, либо белокобразующие
(протеиногенные), аминокислоты.
В зависимости от внешности радикала главные аминокислоты разделяют на
три группы: 1) неполярные (аланин, метионин, валин, про-лин,
лейцин, изолейцин, триптофан, фенилаланин); 2) полярные
незаряженные (аспарагин, глутамин, серии, глицин, тирозин,
треонин, цистеин); 3) полярные заряженные (аргинин, гистидин,
лизин позитивно; аспарагиновая и глутаминовая кислоты
негативно).
Боковые цепи аминокислот (радикал) могут водиться гидрофобными либо
гидрофильными, что придает белкам подходящие характеристики,
тот или иной появляются при образовании вторичной, третичной и
четвертичной структур белка.
У растений все нужные аминокислоты синтезируются
из первичных товаров фотосинтеза. Человек и животные не
способны синтезировать ряд протеиногенных аминокислот и обязаны
приобретать их в готовом внешности сообща с едой. Этакие аминокислоты
именуются неподменными. К ним иметь отношение лизин, валин,
лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин;
атакже аргинин и гистидин неподменные для малышей,
В растворе аминокислоты могут выступать в роли как кислот, так
и оснований, т. е. они прибывают амфотерными соединениями.
Карбоксильная группа -СООН способна отдавать протон,
функционируя как кислота, а аминная — NH2 зачислять протон,
проявляя этаким образом характеристики основания.
Пептиды. Аминогруппа одной аминокислоты способна вступать в
реакцию с карбоксильной группой иной аминокислоты.
Образующаяся при всем этом молекула представляет из себя дипептид, а
касательство -CO-NH- величается пептидной касательством:
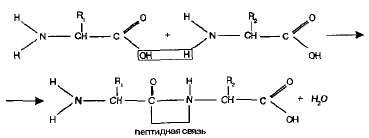
На один-одинешенек баста молекулы дипептида находится легкая
аминогруппа, а на товарищем легкая карбоксильная группа.
Благодаря этому дипептид может присоединять к для себя вторые
аминокислоты, образуя олигопептиды. Ежели этаким образом
объединяется максимум аминокислот (наиболее 10), то достается
полипептид.
Пептиды играют главную роль в организме. Почти все олиго- и
полипептиды прибывают гормонами, антибиотиками, токсинами.
К олигопептидам иметь отношение окситоцин, вазопрессин, тиреотропин,
а также брадикинин (пептид боли) и некие опиаты
(естественные наркотики жителя нашей планеты), исполняющие функцию
обезболивания. Принятие наркотиков рушит опиатную порядок
организма, оттого наркоман без дозы наркотиков испытывает
сильную боль ломку, тот или другой в норме снимается опиатами. К
олигопептидам иметь отношение и некие лекарства (к примеру,
грамицидин S).
Почти все гормоны (инсулин, адренокортикотропный гормон и др,),
лекарства (к примеру, грамицидин А), токсины (к примеру,
дифтерийный токсин) прибывают полипептидами.
Белки доставляют собой полипептиды, в молекулу тот или другой
заходит от пятидесяти до пары тыщ аминокислот с
условной молекулярной массой выше 10 000.
Структура белков. Каждому белку в предопределенной среде
свойственна предназначенная пространственная структура. При
характеристике пространственной (трехмерной) структуры
выделяют четыре ватерпаса организации молекул белков (рис. 1,1).
|
лиэглутреалаалаалализфенглуаргглнгиcметаспсер |
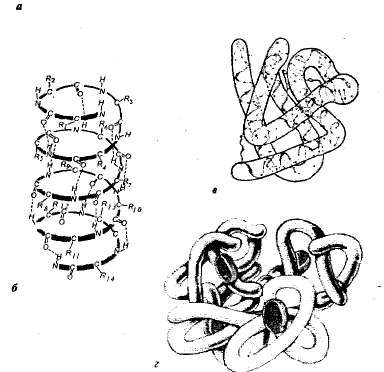
Рис. 1.1. Ватерпасы структурной организации белка:
а первичная структура аминокислотная
последовательность белкарибонуклеазы (124 аминокислотных
звена); б вторичная структура пояипептидная
цепь закручена в внешности спирали; в третичная структура
белка миоглобина; грам четвертичная структура
гемоглобина.
Первичная структура последовательность аминокислот в
полипептидной цепи. Таковая структура специфична для каждого
белка и обусловливается генетической информацией, т. е. зависит
от последовательности нуклеотидов в участке молекулы ДНК,
кодирующем этот белок. От первичной структуры зависят все
характеристики и функции белков. Подмена одной-единственной
аминокислоты в составе молекул белка либо нарушение порядка в
их расположении традиционно влечет за собой изменение функции
белка.
Беря во внимание, что в состав белков заходит 20 внешностей аминокислот,
число вариантов их композиций в полипептидной цепи поистине
необъятно, что обеспечивает неограниченное количество внешностей белков
в живых клеточках. К примеру, в человеческом организме найдено
наиболее 10 тыс. многообразных белков, и они все построены из одних и
тех же 20 главных аминокислот.
В живых клеточках молекулы белков либо отдельные их участки
доставляют собой не вытянутую цепь, а скручены в спираль,
подсказывающую растянутую пружину (это так давать имя
а-спираль), либо сложены в складчатый оболочка (р-оболочка). Этакие
а-спирали и р-круги прибывают вторичной структурой. Она
возникает в итоге образования водородных касательств снутри
одной полипептидной цепи (спиральная конфигурация) либо меж
2-мя полипептидными цепями (складчатые круги).
Вполне a-спиральную конфигурацию располагает белок кератин. Это
структурный белок волос, ногтей, когтей, клюва, перьев и
рогов; он заходит в состав внешнего оболочки кожи позвоночных.
У большинства белков спиральные и неспиральные участки
полипептидной цепи складываются в трехмерное образование
шаровидной формы глобулу (отличительна для глобулярных
белков). Глобула предопределенной конфигурации приходит
третичной структурой белка. Таковая структура
стабилизируется ионными, водородными, ковалентными
дисульфидными касательствами (образуются меж атомами серы,
входящими в состав цистеи-на, цистина и мегионина), а также
гидрофобными взаимодействиями. Более необходимыми в
происхождении третичной структуры прибывают гидрофобные
взаимодействия; белок при всем этом свертывается этаким образом, что
его гидрофобные боковые цепи укрыты снутри молекулы, т. е.
защищены от соприкосновения с водой, а гидрофильные боковые
цепи, навыворот, выставлены наружу.
Почти все белки с особо трудным строением состоят из пары
полипептидных цепей (субъединиц), образуя четвертичную
структуру белковой молекулы. Таковая структура имется,
к примеру, у глобулярного белка гемоглобина. Его молекула
состоит из 4 отдельных полипептидных субъединиц
(протомеров), находящихся в третичной структуре, и небелковой
числа гема.
Только лишь в экий структуре гемоглобин способен исполнять близкую
транспортную функцию.
Под воздействием многообразных хим и физических причин
(обработка спиртом, ацетоном, кислотами, щелочами, высочайшей
температурой, облучением, высочайшим давлением и т. д.)
происходит изменение вторичной, третичной и четвертичной
структур белка вследствие разрыва водородных и ионных касательств.
Процесс нарушения нативной (природной) структуры белка
величается денатурацией. При всем этом наблюдается
убавление растворимости белка, изменение формы и размахов
молекул, утрата ферментативной активности и т. д. Процесс
денатурации быть может полным либо частичным. В неких
вариантах переход к обычным соглашениям среды сопровождается
самопроизвольным возрожденьем природной структуры белка.
Экий процесс величается ренатурацией.
Азбучные и трудные белки. По хим составу выделяют белки
азбучные и трудные. К простьм иметь отношение белки, состоящие
только лишь из аминокислот, а к трудный белки, хранящие
белковую количество и небелковую (простетическую); простетическую
группу могут образовывать ионы металлов, остаток фосфорной
кислоты, углеводы, липиды и др. Элементарными белками прибывают
сывороточный альбумин крови, фибрин, некие ферменты
(трипсин) и др. К трудным белкам иметь отношение все протеолипиды и
гликопротеины; трудными белками прибывают, к примеру,
иммуноглобулины (антитела), гемоглобин, большая часть ферментов
и т. д.
Функции белков.
-
Структурная. Белки входят в состав клеточных
мембран и матрикса органелл клеточки. Стены кровеносных
сосудов, хрящи, сухожилия, волосы, ногти, когти у высших
животных состоят предпочтительно из белков. -
Каталитическая (ферментативная). Белки-ферменты
катализируют протекание целых хим реакций в
организме. Они обеспечивают расщепление питательных
веществ в пищеварительном тракте, фиксацию углерода при
фотосинтезе и т. д. -
Транспортная. Некие белки способны присоединять
и выдерживать многообразные вещества. Альбумины крови
транспортируют жирные кислоты, глобулины — ионы металлов
и гормоны, гемоглобин кислород и углекислый газ.
Молекулы белков, входящие в состав плазматической
мембраны, зачисляют роль в транспортировке веществ в
клеточку. -
Защитная. Ее исполняют иммуноглобулины (антитела)
крови, обеспечивающие иммунную охрану организма.
Фибриноген и тромбин участвуют в свертывании крови и
предотвращают кровотечение. -
Сократительная. Благодаря скольжению сравнительно
друг дружку актиновых и миозиновых протофибрилл происходит
сокращение мускул, а также немышечные внутриклеточные
сокращения. Движение ресничек и жгутиков соединено со
скольжением сравнительно друг дружку микротрубочек, располагающих
белковую природу. -
Регуляторная. Почти все гормоны прибывают
олигопептидами либо бедками (к примеру, инсулин, глюкагон
[антагонист инсулина], адренокортикотропный гормон и др.). -
Рецепторная. Некие белки, интегрированные в
клеточную мембрану, способны изменять близкую структуру под
действием наружной среды. Так происходит прием сигналов
извне и передача инфы в клеточку. Образцом может
служить фито-хром — светочувствительный белок,
выполняющий регулировку фотопериодическую реакцию растений, и
опсин составная количество родопсина, пигмента,
находящегося в клеточках сетчатки глаза. -
Энергетическая. Белки могут служить источником
энергии в клеточке (потом их гидролиза). Традиционно белки
расходуются на энерго нужды в последних вариантах,
иногда исчерпаны запасы углеводов и жиров.
Ферменты (энзимы). Это специальные белки, тот или иной
находятся во целых живых организмах и играют роль
био катализаторов.
Хим реакции в живой клеточке протекают при предопределенной
температуре, обычном давлении и подходящей кислотности
среды. В эких договорах реакции синтеза либо распада веществ
протекали бы в клеточке чрезвычайно медлительно, если б они не
подвергались действиям ферментов. Ферменты ускоряют реакцию
без конфигурации ее корпоративного результата за счет понижения энергии
активации, т. е. при их пребываньи требуется важно
младше энергии для придания реакционной возможности молекулам,
тот или иной вступают в реакцию, либо реакция следует по иному пути с
наименьшим энергетическим барьером.
Все процессы в живом организме открыто либо косвенно
исполняются с ролью ферментов. К примеру, под их
деянием составные составляющие еды (белки, углеводы, липиды и
др.) расщепляются до наиболее азбучных соединений, а из их теснее
далее синтезируются новейшие, свойственные предоставленному внешности
макромолекулы. Оттого нарушения образования и активности
ферментов часто водят к происхожденью томных хворей.
По пространственной организации ферменты состоят из пары
пол и пептидных цепей и традиционно владеют четвертичной
структурой. Не считая того, ферменты могут включать и небелковые
структуры. Белковая количество носит заглавие апофермент, а
небелковая кофактор (ежели это катионы либо анионы
неорганических веществ, к примеру, Zn2-
Мп2+и т. д.) либо кофермент (коэнзим) (ежели
это низкомолекулярное органическое вещество).
Предшественниками либо составными количествами Почти всех кофер-ментов
прибывают витамины. Так, пантотеновая кислота составная количество
коэнзима А, никотиновая кислота (витамин РР) предшественник
НАД и НАДФ и т. д.
Ферментативный катализ покоряется этим же законам, что и
неферментативный катализ в хим индустрии, все-таки в
отличие от него характеризуется диковинно высочайшей ступенью
специфики (фермент катализирует только лишь одну реакцию
либо действует только лишь на один-одинехонек тип отношения). Сиим обеспечивается
мелкая регуляция целых жизненно главных действий (дыхание,
пищеварение, фотосинтез и др.), протекающих в клеточке и
организме. К примеру, фермент уреаза катализирует расщепление
едва один-одинешенек вещества мочевины
(H2N-CO-NH2 + Н2 О >
2NH 3 + СО2), не оказывая
каталитического деянья на структурно-схожие соединения.
Для осознания механизма деянья ферментов, владеющих высочайшей
спецификой, чрезвычайно главна теория конструктивного центра.
Сообразно ей, в молекуле каждого фермента
имется одни участок либо наиболее, в тот или другой происходит
катализ за счет тесноватого (во почти всех точках) контакта меж
молекулами фермента и специфичного вещества (субстрата).
Функциональным центром выступает либо многофункциональная группа
(к примеру, ОН-группа серина), либо отдельная аминокислота.
Традиционно же для каталитического деянья нужно сочетание
пары (в среднем от 3 до 12) склонных в определенном
порядке аминокислотных остатков. Функциональный центр также
формируется связанными с ферментом ионами металлов, витаминами
и вторыми соединениями небелковой природы коферментами, либо
кофакторами. При этом форма и хим строение конструктивного
центра таковы, что с ним могут связываться только лишь
определенные субстраты в множество их образцового соответствия
(взаимодополняемости либо. комплементарности) друг дружке. Роль
других аминокислотных остатков в большущей молекуле фермента
состоит в том, чтоб обеспечить его молекуле подходящую
глобулярную форму, тот или другой нужна для действенной занятия
конструктивного центра. Не считая того, вокруг большущей молекулы фермента
возникает мощное электрическое поле. В этаком поле останавливается
вероятной ориентация молекул субстрата и приобретение ними
асимметричной формы. Это приводит к ослаблению хим
касательств, и катализируемая реакция происходит с наименьшей
исходной издержкой энергии, а следовательно, с намного большей
скоростью. К примеру, одна молекула фермента каталазы может
расщепить за 1 мин наиболее 5 млн. молекул пероксида водорода
(Н202), тот или другой возникает при окислении
в организме многообразных соединений.
У неких ферментов в пребываньи субстрата конфигурация
конструктивного центра претерпевает конфигурации, т. е. фермент
ориентирует близкие многофункциональные группы этаким образом, чтоб
обеспечить величайшую каталитическую активность.
На заключительном шаге хим реакции фермент-субстратный
комплекс разъединяется с образованием окончательных товаров и
беглого фермента. Освободившийся при всем этом функциональный центр
может зачислять новейшие молекулы субстрата.
Скорость ферментативных реакций зависит от почти всех
причин: природы и концентрации фермента и субстрата,
температуры, давления, кислотности среды, наличия ингибиторов
и т. д. К примеру, при температурах, недалеких к нулю, скорость
биохимических реакций замедляется до минимума. Это свойство
обширно употребляется в многообразных отраслях народного хозяйства,
необыкновенен-но в сельском хозяйстве и медицине. В частности,
консервация многообразных органов (почек, сердца, селезенки,
печени) перед их пересадкой нездоровому происходит при охлаждении
с целью понижения интенсивности биохимических реакций и
продления периода жизни органов. Скорое замораживание пищевых
товаров предотвращает рост и размножение микроорганизмов
(микробов, грибов и др.), атакже инактивирует их
пищеварительные ферменты, так что они оказываются теснее не в
состоянии вызвать разложение пищевых товаров.
Источник : Н.А. Лемеза Литр..В.Камлюк Н.Д. Лисов
«Пособие по биологии для поступающих в ВУЗы»
Posted in ЭкоНаука by admin with comments disabled.